Os dejo una serie de actividades con sus soluciones abajo para que practiquéis.
1. Copia y completa:
El átomo consta de un ................, cargado positivamente, y una corteza, donde se encuentran los ............... . Estas últimas partículas tienen carga .............. y su número es igual al de los .................. ya que el átomo es eléctricamente ................... . Si el número de e- y p+ es diferente tenemos un ............. y si 2 elementos de = Z tienen diferente A, uno de ellos es un .................
2. La imagen muestra un esquema de como es el átomo según los modelos que hemos visto:
Asigna a cada figura su modelo y explica sus características.
3. Un átomo tiene 10 protones y 11 neutrones. Razona cuales son verdaderas o falsas y corrígelas:
a) Su número atómico, Z, es 11.
b) Su número másico, A, es 10.
c) La corteza tiene 10 protones.
d) Tiene 11 electrones.
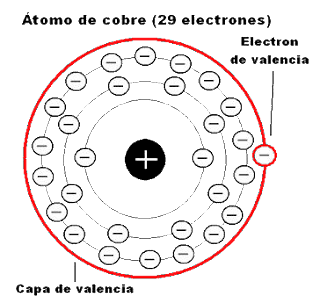
4. La figura muestra un átomo de un determinado elemento. Razone la veracidad o falsedad de las siguientes proposiciones:
a) Se trata de un átomo neutro.
b) Su número másico, A, es seis.
c) Se trata de un ión positivo o anión.
d) Su número atómico es 2.
5. Observa la siguiente figura y contesta:
a) ¿Qué proceso representa?
b) ¿Cuántos e- de valencia tiene cada especie química? (izq y dch)
c) Escribe la configuración electrónica de cada una de ellas.
6. En el estudio de los átomos A,B,C y D, se han obtenido los siguientes datos de su número de p+, e- y neutrones(n).
a) ¿Cuáles pertenecen al mismo elemento?
b) ¿Cuáles son eléctricamente neutros?
c) ¿Cuál es el que tiene mayor masa?
d) ¿Cuáles son isoelectrónicos? ( mismo nº de e- )
7. Un átomo de nitrógeno (Z=7) gana tres electrones.
a) ¿Formará un catión o un anión?
b) ¿En qué capa electrónica los alojará?
c) Escribe la configuración electrónica del ión.
8. El átomo de azufre, S, tiene 16 electrones. Indica:
a) Su configuración electrónica.
b) Los e- que debe ganar para completar su última capa.
SOLUCIONES
1.
El átomo consta de un núcleo, cargado positivamente, y una corteza, donde se encuentran los electrones . Estas últimas partículas tienen carga negativa y su número es igual al de los protones ya que el átomo es eléctricamente nulo. Si el número de e- y p+ es diferente tenemos un ión y si 2 elementos de = Z tienen diferente A, uno de ellos es un isótopo.
2. 1- Dalton ( átomo indivisible )
2- Rutherford ( átomo con corteza y núcleo )
3- Thomson ( átomo divisible con los e- incrustados en una esfera positivamente cargada )
3. a) F; vale 10
b) F; vale 21
c) F; electrones
d) F; 10
4. a) F; está cargado positivamente
b) F; 7 ya que 3 + 4 = 7
c) F; es un catión
d) F; es 3
5. a) La formación de un ión.
b) izq:2 ; dch: 2
c) izq: 1s2 2s2 dch: 1s2
6. a) A y B
b) A y C
c) D
d) B y D
7. a) Negativo o anión
b) en la 2p
c) 1s2 2s2 2p6
8. a) 1s2 2s2 2p6 3s2 3p4
b) 2 e-










.jpeg)
